-
100

- 안희경 (시스템생물 08) 동문의 에든버러 대학교 교수 임용
- 안희경 (시스템생물 08) 동문의 에든버러 대학교 교수 임용 안희경 동문의 에든버러 대학교 임용이 확정되었다. 2024년 11월부터 에든버러 대학교 생명과학부 내 식물분자생물학 연구소 (Institute of Molecular Plant Sciences)에서 근무하게 된다. 여기에 런던왕립학회에서 수여하는 University Research Fellow에도 선정되었다. 전 과학 분야에 걸쳐 해마다 30명 정도를 뽑는 URF는 학문후속세대에게는 가장 권위있는 펠로십으로 8년간 총 180만 파운드 (한화로 약 30억원)을 지원받게 된다. 2008년 연세대학교 생명시스템대학에 입학해 시스템생물학과를 졸업했고, 부전공으로 사학을 수료했다. 2011년부터 동대학원 배현숙 교수님 연구실에서 석박사통합과정을 지냈다. 2018년 4월부터 영국 노리치 The Sainsbury Laboratory (TSL)의 조나단 존스 교수님 연구실에서 박사후연구원 기간을 보냈다. 어려서는 식량 자원이라는 측면에서만 작물에 관심을 가졌으나, 우연한 기회에 배현숙 교수님 연구실에서 학부 연구생으로 지내면서 식물을 연구하는 것 자체에 매력을 느끼게 되었다. 특히 여러 단백질이 한데 모인 복합체를 연구하면서, 세포 내 단백질 복합체 형성 및 유지에 관심을 갖기 시작했다. 존스 교수님 연구실에서는 병원균을 인식하는 식물 세포 내 수용체 연구를 진행했다. 특히 박사과정 연구를 기반으로 병원균을 인식하는 세포 내 수용체가 다양한 형태의 복합체를 이루는 것을 보였다. 에든버러 대학교에서는 이 수용체가 복합체를 형성하는 원리를 밝히고 이를 바탕으로 새로운 병원균 수용체를 찾아내는 방법을 연구할 예정이다.
- 시스템생물학과 관리자 2024.06.27
-
99

- 정지연(시스템 생물 03) 동문, 하버드대 교수 임용
- 정지연(시스템 생물 03) 동문, 하버드대 교수 임용 정지연(시스템 생물 03) 동문이 2023년 1월 하버드대 교수로 임용되었다는 낭보가 들려왔다. 학부에서 생물학 공부를 시작한 지 20년 되는 해에 하버드대 교수가 되었다. 정 동문은 연세대학교에서 시스템 생물학과 학사와 석사 학위를 받고 예일대에서 박사 학위 취득 후 교수 임용 전까지 하버드 의과대 박사연구원으로 활동했다. 정 동문이 연구자와 교수자의 길을 걷게 된 시작은 학부 때 시스템생물학과 정인권 교수의 바이러스학 강의로 거슬러 올라간다. 그 때 그 수업이 너무 재미있어서 대학원에서도 정인권 교수 연구실에서 공부하고 박사 유학까지 하게 되었다. 정 동문은 “연구에 있어 개개인의 독립성을 이끌어 주셨던 정인권 교수님 덕분에 연구를 재미있게 해왔다. 그 결과가 지금의 나를 만들었다”고 회상하며 “정인권 교수님을 롤모델로 삼고 학생들을 지도하고 연구 활동을 해나가고 싶다”고 했다. 정지연 동문은 앞으로 뇌 안에서 지방이 저장되고 사용되는 메커니즘을 연구함으로써 치매와 파킨슨병 등 뇌 질환의 새로운 해법을 제시하려고 한다. 사람들은 보통 지방을 다이어트와 연관 지어 생각하지만 정 동문은 다이어트보다는 뇌과학적 측면에서 지방의 중요성을 주목한다. 보이지 않지만 뇌 안에도 여러 지방이 존재하고 지방이 과하거나 부족하면 큰 문제가 일어난다. 이 과정에서 지방질이 뇌에서 어떤 역할을 하고 또 어떻게 신경계에 영향을 미치는지 연구할 예정이다. 정 동문은 ‘진리가 너희를 자유케 하리라’는 연세 정신을 소중한 격언으로 받아들여왔다 왜냐하면 스스로 좋아하는 학문이나 일에 몰입하면 그 과정이 아무리 힘들어도 그 속에서 즐거움, 나아가 자유를 느낄 수 있기 때문이다. “연세 정신의 핵심을 ‘과정을 즐겨라’로 해석한다”는 정 동문은 “지금 연구하는 학문의 진리로부터 즐거움을 느껴 보기를 바란다. 그러면 좋은 결과는 자연스럽게 따라 온다”는 말로 후배들에 대한 조언을 전했다.
- 시스템생물학과 관리자 2024.06.03
-
98
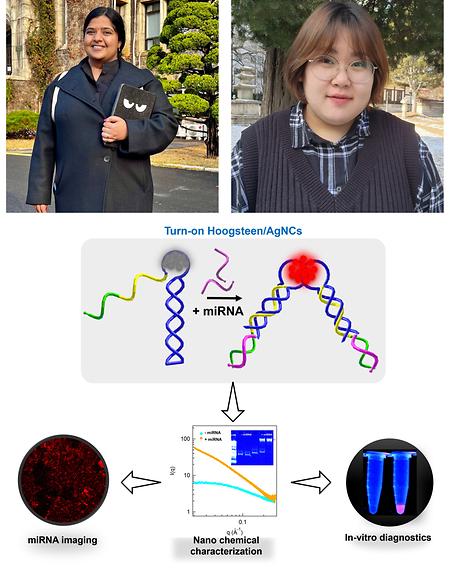
- 양성욱 교수 연구팀, Hoogsten DNA-은나노 클러스터 센서가 표적 miRNA와 결합 시 적색 형광을 방출함을 규명
- 양성욱 교수 연구팀, Hoogsten DNA-은나노 클러스터 센서가 표적 miRNA와 결합 시 적색 형광을 방출함을 규명 시스템생물학과 양성욱 교수 연구팀은 덴마크 Roskilde University Pratik Shah 교수 연구팀, 본교 양원호 교수 연구팀과의 공동 연구를 통해 Tailed-Hoogsteen 삼중 DNA 기반 은나노클러스터가 표적 miRNA 탐지와 결합, 빨간색 형광을 방출함을 규명하였다. 은나노클러스터(AgNCs)의 Hoogsteen 삼중 DNA 구조를 사용하여 타겟 miRNA를 세포 외 탐지하거나, 세포내 이미징이 동시에 가능한 기술이다. 본 연구는 그 우수성을 인정받아 Small 지에 2023년 11월 온라인 게재되었다. (Tailed-Hoogsteen Triplex DNA Silver Nanoclusters Emit Red Fluorescence upon Target miRNA Sensing. Small (IF: 13.3). 15th Nov 2023. Online ahead of print. https://doi.org/10.1002/smll.202306793). 본 연구에서 저자들은 Tailed-Hoogsteen 삼중 DNA에 싸인 은나노클러스터(DNA/AgNC)를 사용하여 표적 miRNA를 감지하는 새로운 방법을 제시하였다. 센서 끝에 달려 있는 tail 염기서열은 miRNA와 상보적이며, 이 tail과 miRNA가 결합할 시 Tailed-Hoogsteen 삼중 DNA/AgNC는 뚜렷한 빨간색 형광을 방출함을 확인하였다. 다음으로 이 miRNA 센서가 세포에서 추출한 전체 RNA 속에서도 표적 miRNA를 효과적으로 탐지함을 확인하였다. 이어서 양원호 교수 연구팀의 도움으로 대장암 세포주 내에 miR-21을 탐지할 수 있는 센서를 도입하였고, 그 결과 DNA/AgNC 기반 센서를 이용한 이미징을 최초로 성공하였다. 이는 기존의 DNA/AgNC 기반 miRNA 센서들이 주로 turn-off mechanism을 가지고 있어 세포 이미징에 적용하기 어려웠다는 점과 비교했을 때 본 연구팀이 개발한 센서가 갖는 큰 장점이라고 할 수 있다. 또한 본 연구팀은 젤 전기영동 기반 형광 분석 및 SAXS(소각 X선 산란) 분석을 통해 Tailed-Hoogsteen 삼중 DNA/AgNC가 표적 miRNA 탐지, 결합 시 단량체에서 이량체로 변함을 확인, turn-on 센서의 형광 방출 메커니즘을 규명하였다. 종합적으로, 본 연구 결과는 Tailed-Hoogsteen 삼중 DNA/AgNC가 in vitro 이미징 및 세포 내 이미징 모두에서 miRNA 탐지를 위한 효율적인 센서로서 이용될 수 있음을 시사한다. 공동 제1저자 Hari Chandana Yadavalli 학생, 박수연 학생 Small논문 모식도 참여 저자: Hari Chandana Yadavalli†, Sooyeon Park†, Yeolhoe Kim, Tae-Hwan Kim, Min Kyun Han, Il Lae Jung, Yong Joo Bhang, Won Ho Yang, Louise Torp Dalgaard, Seong Wook Yang*, Pratik Shah* (†: 공동 제1저자, *: 교신저자)
- 시스템생물학과 관리자 2023.11.20
-
97

- 허지원 박사, 충남대학교 생명정보융합학과 임용
- 허지원 박사, 충남대학교 생명정보융합학과 임용 생명시스템대학 시스템생물학과 미생물유전체학 및 시스템/합성생물학 연구실(김지현 교수)의 연구교수인 허지원 박사의 충남대학교 생명시스템과학대학 생명정보융합학과 소속 전임교원으로 임용이 확정되었다. 허 박사는 2023년 9월 1일부터 마이크로바이옴 전공 분야를 담당하는 조교수로 근무하게 된다. 허지원 박사는 포스텍에서 면역학 박사학위를 받은 후 생물정보학으로 연구분야를 전환하였으며, 2020년 김지현 교수 연구실에 합류하여 인체 마이크로바이옴과 질병의 연관성에 대한 연구를 담당하였다. 허 박사는 '대장암 환자의 분변 미생물을 활용한 예후 예측' 및 '젊은 마우스 유래 장 미생물군집을 통한 늙은 마우스의 노화개선' 연구를 성공적으로 수행하여, 지난 해 해당 분야의 세계적 학술지인 Microbiome (JCR 2022 IF 15.5)에 두 편의 논문을 게재하였다. 한편, 김지현 교수의 미생물유전체학연구실에서는 권순경 연구교수가 지난 2019년 3월 1일 경상국립대학교 자연과학대학 생명과학부에 미생물유전체학 전공 조교수로 부임하여(현재 부교수) 시스템미생물학연구실을 이끌고 있다.
- 시스템생물학과 관리자 2023.07.19
-
96

- 김지현 교수, 한국미생물·생명공학회 학술대상 수상
- 김지현 교수, 한국미생물·생명공학회 학술대상 수상 생명시스템대학 시스템생물학과 김지현 교수는 2023년 6월 22일 경주화백컨벤션센터에서 개최된 '2023년 학회 창립 50주년 기념 국제학술대회 및 정기학술대회' 정기총회에서 대장균 세포공장을 비롯한 다양한 미생물의 유전체와 다중오믹스 시스템 분석 및 생명 진화와 마이크로바이옴 연구를 통해 미생물유전체학과 시스템/합성생물학 및 학회의 발전에 기여한 공로로 학술대상을 수상했다. 김지현 교수는 2000년부터 학회의 정회원으로 활동하면서(2009~현재, 평의원), Journal of Microbiology and Biotechnology Editor (2005~2007), 학술간사(2014), 재무간사(2015), 감사(2018), 학술진흥위원장(2021), 이사(2023) 등을 역임하며, 미생물유전체전략연구사업(2014~2022) 단장으로서 지속적으로 학술대회를 후원하고 심포지엄 세션을 운영하는 등 학회의 발전을 위해 헌신적으로 봉사해왔을 뿐만 아니라, J. Microbiol. Biotechnol.에 게재한 교신저자 논문 2편(2017, 2020)을 포함하여 미생물 유전체 분석과 기능 및 진화 연구(Trends Genet 2001; Nucleic Acids Res. 2005, 2007; Nature 2009; Genome Biol. Evol. 2013; Nat. Commun. 2016), 대장균 세포공장의 유전체 및 다중오믹스 시스템 분석(J. Mol. Biol. 2009; Genome Biol. 2012), 마이크로바이옴 연구(Nat. Biotechnol. 2018; Gut 2021; Microbiome 2021, 2022a, 2022b)를 비롯한 연구/리뷰 논문 120여 편, 특허 및 프로그램 등록 50여 건 등 미생물·생명공학 분야에서 이룩한 탁월한 연구업적은 국가연구개발 우수성과 100선(2010, 2019), 교육과학기술부 장관상(2011), 과학기술정보통신부 장관표창(2019), 대통령표창(2022)과 대한민국학술원상(2019) 등의 수상을 통해 검증된 바 있다.
- 시스템생물학과 관리자 2023.07.17
-
95

- 김국래 박사, 연세대학교 약학과 임용
- 김국래 박사, 연세대학교 약학과 임용 생명시스템대학 시스템생물학과 구조생물학 연구실(조현수 교수)의 제자인 김국래 박사는 연세대학교 약학대학 약학과 소속 전임교원으로 임용이 확정되었다. 김 박사는 2022년 3월 1일부터 구조생물학과 물리약학 전공 분야를 담당하는 조교수로 근무하게 된다. 김국래 박사는 연세대학교 시스템생물학과에서 구조생물학 박사학위를 받은 후 미국 University of North Carolina at Chapel Hill의 Bryan Roth 연구실에서 박사후 연구원으로 있으면서 5년간 GPCR 구조연구 뿐만 아니라 약리학으로 연구를 확장 진행하였으며, 2020년 CELL 지에 제 1저자로 논문을 게제 하였으며, 이후 제1저자로 NATURE(2022), NEURON(2022), Nature Communications(2023) 등의 우수 학술지에 논문을 게제 하였다. 조현수 교수는 막 단백질 구조연구 분야에서 15년 이상 오랫동안 연구를 해오고 있고 수많은 업적과 노하우가 있으며 우수한 학생들과 함께 연구를 진행하고 있다.
- 시스템생물학과 관리자 2023.07.17
-
94
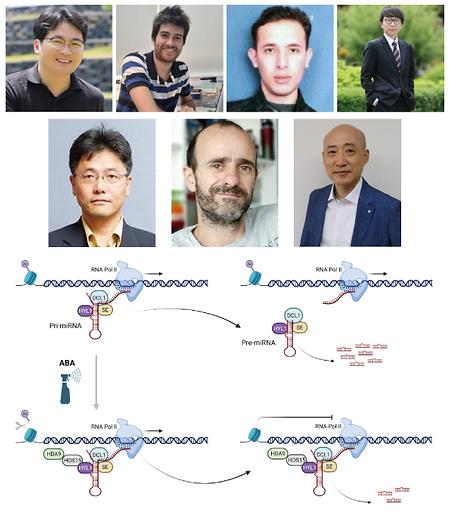
- 양성욱 교수 연구팀, 크로마틴 변형 복합체가 식물 호르몬인 아브시스산 (ABA)에 반응하여 microRNA 발현을 조절함을 규명
- 양성욱 교수 연구팀, 크로마틴 변형 복합체가 식물 호르몬인 아브시스산 (ABA)에 반응하여 microRNA 발현을 조절함을 규명 시스템생물학과 양성욱 교수 연구팀은 건국대학교 윤대진 교수 연구팀, 아르헨티나 Instituto de Agrobiotecnología del Litoral (CONICET-UNL) Pablo A. Manavella 박사 연구팀과의 공동 연구를 통해 HOS15-HDA9 크로마틴 변형 복합체가 HYL1과 결합하여 ABA 처리 하에서 microRNA (miRNA) 발현을 억제함을 규명하였다. 본 연구는 미국식물학회 (American Society of Plant Biologist)에서 발행하는 식물학 분야 저명 학술지인 ‘The Plant Cell’지에 (5-year IF: 12.796) 2023년 5월 게재되었으며, 독창성과 우수성을 인정받아 ‘in brief’로 선정 및 소개되기도 하였다. (The HOS15-HDA9 complex associates with HYL1 to modulate miRNA expression in response to ABA signaling. The Plant Cell. 17 May 2023. Online ahead of print. https://doi.org/10.1093/plcell/koad132). miRNA는 21-24 뉴클레오타이드의 길이를 가지는 작은 비번역 RNA로 생체 내 mRNA 침묵과 번역 억제에 중요한 역할을 한다. 식물에서 miRNA는 RNA polymerase II에 의해 전사되고 DCL1, HYL1, SERRATE를 핵심 인자로 갖는 마이크로프로세서에 의해 프로세싱 된다. 식물에서의 항상성 유지와 적절한 발달 프로그래밍을 위하여 마이크로프로세서 및 miRNA는 전사 및 전사 후 단계에서 매우 엄격하게 조절되고 있다. 식물이 환경 스트레스에 노출되었을 때 miRNA는 유전자 발현 조절의 핵심적인 역할을 한다. 본 연구팀은 forward genetic 스크리닝을 통해 스트레스 반응 복합체로 잘 알려진 HOS15-HDA9 복합체가 miRNA 생합성에 관여함을 확인하였다. 이에 HOS15-HDA9 복합체와 miRNA 생합성 경로에서의 작용 메커니즘 및 마이크로프로세서와의 관련성을 확인하고자 하였다. 이에 더해, HOS15-HDA9 복합체가 식물에서의 스트레스 관련 호르몬인 ABA signaling 하에서의 miRNA 발현 조절 주요 인자인지를 확인하고자 하였다. 그 결과, 본 연구팀은 HOS15-HDA9 복합체가 HYL1과 결합하며, ABA 처리 하에서 miRNA 발현의 조건적 억제자로 작용함을 확인하였다. 또한, HYL1과 초기 pri-miRNA (nascent primary miRNA)의 결합이 HOS15-HDA9 복합체를 miRNA 유전자 loci에 위치할 수 있도록 하고, 그 결과 HOS15-HDA9 복합체가 miRNA 발현을 억제하며 pri-miRNA 프로세싱을 저해함을 확인하였다. 따라서, 본 연구 결과는 초기 pri-miRNA가 miRNA 유전자 loci에 전사 조절자들을 위치할 수 있도록 하는 스캐폴드로 작용, miRNA의 전사 및 프로세싱을 조절할 수 있음을 보여주었다. 참여 저자: Junghoon Park†, Axel J Giudicatti†, Zein Eddin Bader†, Min Kyun Han†, Christian Møller, Agustin L Arce, Zheng-Yi Xu, Seong Wook Yang*, Pablo A Manavella*, Dae-Jin Yun* (†: 공동 제1저자, *: 교신저자) 상단: (좌측 상단부터 시계방향으로) 공동 제1저자 박정훈 박사, Axel J Giudicatti 학생, Zein Eddin Bader 박사, 한민균 학생, 공동 교신저자 윤대진 교수, Pablo A Manavella 박사, 양성욱 교수 하단: ‘The Plant Cell’ 지에 in brief로 소개된 본 논문의 모식도 (https://doi.org/10.1093/plcell/koad135)
- 시스템생물학과 관리자 2023.05.22
-
93
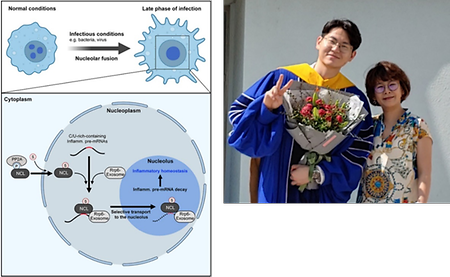
- 박보연교수, 이태윤박사(제1저자), 면역 항상성을 유도하는 핵소체의 새로운 기전 규명, 'Nature Communications' 게재
- 박보연교수, 이태윤박사(제1저자), 면역 항상성을 유도하는 핵소체의 새로운 기전 규명, 'Nature Communications' 게재 시스템생물학과 박보연 교수, 이태윤 박사(제 1저자)는 감염 시 핵소체(Nucleolus)가 염증성 사이토카인 유전자 발현 조절을 통한 면역 항상성 유도할 수 있는 새로운 면역학적 기능을 밝혀 세계적 국제 학술지인 'Nature Communications' 온라인 판 (2022. 09. 03일)에 게재되었다. (The nucleolus is the site for inflammatory RNA decay during infection. Nature Communications, 13, Article number: 5203 (2022). 사이토카인(cytokine)은 면역 반응을 조절하는 중요한 단백질로서 면역 항상성을 유지하기 위해서 매우 정교하게 조절되어야 한다. 현재까지의 연구는 세포질 또는 핵질에서 사이토카인 RNA 제거 기전에 집중되어 있었으며, ribosomal RNA의 생합성에 중요한 장소로 잘 알려진 핵소체(nucleolus)와 연관된 면역 항상성 기전은 연구된 바 없었다. 박보연 교수 연구팀은 감염 시 대식세포 핵소체의 형태학적 변화를 관찰하였고 이를 기반으로 핵소체에 존재하는RNA-sequencing 분석을 통해 염증성 사이토카인 pre-mRNA가 Nucleolin (NCL)이라는 가이드 단백질을 통해 핵소체로 이동하여 선택적으로 제거한다는 것을 확인하였다. 본 연구 결과를 통해 향후 과도한 면역 활성으로 인해 유도되는 암, 자가면역질환 등의 면역질환 치료제 개발에 중요한 단서를 제공할 것으로 기대된다. 본 연구는 박보연 교수 연구팀의 이태윤 박사(제 1저자)가 주도하였고, 국립 암 센터 책임연구원 이성욱 박사 연구팀과 Medical University of South Carolina (USA) 윤제현 교수팀이 참여하였다. 또한 본 연구는 삼성미래기술육성사업 및 한국연구재단의 중견연구자지원사업 전략연구 지원 등으로 수행되었다. 왼쪽: 감염 시 핵소체 내 염증성 사이토카인의 pre-mRNA 제거 기전 오른쪽: 본 연구를 주도한 이태윤 박사(제 1저자; 왼쪽)와 박보연교수(오른쪽)
- 시스템생물학과 관리자 2023.03.02
-
92
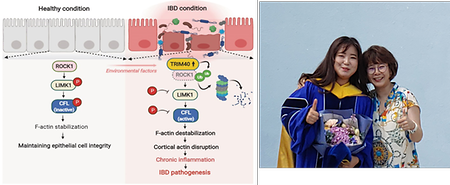
- 박보연교수, 강수진박사(제1저자), 염증성 장 질환(Inflammatory Bowel Disease) 촉발 기전 규명, ‘Nature Communications’ 최신호 게재
- 박보연교수, 강수진박사(제1저자), 염증성 장 질환(Inflammatory Bowel Disease) 촉발 기전 규명, 'Nature Communications' 최신호 게재 시스템생물학과 박보연 교수, 강수진 박사(제 1저자)는 자가면역질환인 염증성 장 질환(IBD)의 발병 기전을 밝혀 세계적 국제 학술지인 'Nature Communications' 온라인 판 (2023. 02. 09일)에 게재되었다. (TRIM40 is a pathogenic driver of inflammatory bowel disease subverting intestinal barrier integrity. Nature Communications, 14(1):700. doi: 10.1038/s41467-023-36424-0.) 염증성 장 질환(Inflammatory bowel disease, IBD)은 현재 우리나라를 포함하여 전 세계적으로 수직적으로 증가하고 있으며, 발병 원인이 불분명하고 정확한 타깃 치료제가 없는 질환이며, 다른 자가 면역 질환 및 우울증 및 불안장애 등의 신경정신 질환의 빈도의 증가와도 연관이 높기 때문에 근본적인 발병 원인 및 치료제 개발이 시급한 실정이다. 박보연 교수 연구팀은 다양한RNA-seq 분석 결과를 기반으로 IBD 환자의 경우 비정상적으로 장 상피세포의TRIM40 유전자의 발현이 증폭되어 있음을 확인하였고, 이는 세포 골격체 변성을 통한 장 상피세포 간 부착 능력을 파괴하여 IBD를 촉발함을 확인하였다. 본 연구 결과를 통해 향후 IBD 질환의 정확한 진단 기법 및 치료제 개발에 중요한 단서를 제공할 것으로 기대된다. 본 연구는 박보연 교수 연구팀의 강수진 박사(제 1저자)가 주도하였고, 국립 암 센터 책임연구원 이성욱 박사 연구팀과 연세대 의과대학 천재희 교수팀이 참여하였다. 또한 본 연구는 바이오의료기술개발 사업, 중견연구자지원사업 및 삼성미래기술육성사업 지원 등으로 수행되었다. 왼쪽: 염증성 장 질환의 촉발 기전 오른쪽: 본 연구를 주도한 강수진 박사(제 1저자; 왼쪽)와 박보연교수(오른쪽)
- 시스템생물학과 관리자 2023.03.02
-
91

- 김지현 교수, 정유숙·허지원 박사 등 “마이크로바이옴이 근육과 피부를 다시 젊게 한다”
- 김지현 교수, 정유숙·허지원 박사 등 “마이크로바이옴이 근육과 피부를 다시 젊게 한다” 마이크로바이옴(microbiome)은 대사와 면역에 중요한 역할을 하며 장내 미생물 불균형은 암을 비롯한 각종 질환을 유발할 수 있다. 대변 미생물군집 이식(fecal microbiota transplantation)을 통해 근육과 피부 노화를 되돌릴 수 있다는 사실이 우리나라 연구진에 의해 규명되었다. 생명시스템대학 시스템생물학과 김지현 교수와 정유숙·허지원 박사 등은 교내외 공동연구를 통해 사람의 청소년기에 해당하는 어린 마우스의 장내 미생물군집을 중장년기와 노년기의 나이든 마우스에게 이식하면 근육과 피부의 노화 지표가 개선되는 것을 발견하여, 이와 관련된 미생물을 도출하고 이들이 마우스에서 발현이 증가한 유전자와도 상관성이 있다는 사실을 규명했다. 장내 마이크로바이옴을 이루는 미생물은 생애주기에 따라 변하는데, 비교적 안정적인 성년기를 지나 노년기에 접어들면 변동성이 커지면서 신체의 기능성 약화의 원인이 될 수 있다고 알려져 있다. 연구팀은 어린 마우스의 장내 미생물군집을 나이든 마우스에게 이식하는 실험을 수행하여 나이든 마우스의 근육의 근섬유 두께와 근력이 향상되고 피부의 각질층 두께와 수분 함유량이 증가하는 것을 관찰하였다. 이는 근육·피부 노화가 장내 미생물을 통해 회복될 수 있는 가역적인 현상이라는 것을 규명한 연구이다. 노화가 계획된 생물학적 프로그램이라는 ‘노화예정(programmed aging)이론’은 나이든 신체의 젊음을 되돌리는 것도 가능하다는 것을 시사한다. 또한, 나이든 마우스에 어린 마우스 또는 나이든 마우스의 장내 미생물군집을 이식한 후 미생물 종류와 노화 지표와의 상관관계 분석을 통해 Prevotellaceae 과에 속하는 세균을 대표적인 노화 개선 관련 미생물로 제안하였다. Prevotellaceae는 인간의 대표적인 장내 미생물타입(enterotype) 중 하나인 Prevotella 속을 포함하고 있으며, 서구화된 육류 위주 식단 대신 섬유질이 풍부한 채소·곡물 위주의 식단을 섭취할 경우 증가한다고 알려져 있다. 과학기술정보통신부와 한국연구재단이 추진하는 다부처 국가생명연구자원 선진화사업, 바이오‧의료기술개발사업, 연세 시그니처 연구클러스터사업 등의 지원으로 수행된 이번 연구의 성과는 미생물학 및 마이크로바이옴 연구 분야의 권위 있는 국제학술지인 ‘마이크로바이옴(Microbiome; 2021년 JCR IF = 16.837)’에 지난 12월 26일 온라인 게재되었고 관련 특허도 출원되었다. < 논문정보 > ● 논문제목: Gut microbiota of the young ameliorates physical fitness of the aged in mice ● 논문주소: https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01386-w ● 관련 영상: https://www.youtube.com/watch?v=oHkolX8026s ● 관련 기사: https://biz.chosun.com/science-chosun/science/2023/01/10/JDXHNMEPXRGQJHLOTDL6JJNWZ4/
- 시스템생물학과 관리자 2023.01.13

